生活中常见的盐 教案
二、碳酸钠、碳酸氢钠、碳酸钙
1.了解碳酸钠、碳酸氢钠和碳酸钙在生活中的主要用途。
2.能根据复分解反应发生的条件判断酸、碱、盐之间的反应能否发生。
3.掌握碳酸根离子检验的方法。
1.化学与生活、生产的关系。
2.酸、碱、盐的反应──复分解反应。
1课时
课件、试管、碳酸钠、碳酸氢钠、盐酸、食醋、石灰水等。
(复习练习)
(1)写出下列化学反应的化学方程式
氢氧化钠与盐酸的反应:
(2)如何检验二氧化碳气体?(口答)
一、碳酸钠、碳酸氢钠、碳酸钙的用途
(展示图片、实物) 请学生举例碳酸钠、碳酸氢钠、碳酸钙在生活中的主要用途。
(演示盐酸腐蚀大理石实验)写出此化学反应的化学方程式。
(引入):比较碳酸钙(CaCO3)、碳酸钠(Na2CO3)、碳酸氢钠(NaHCO3)的化学式有何相似之处?
(提问)碳酸钠和碳酸氢钠是否也能发生类似的反应呢?
二、化学性质
1.与酸反应
师生探究实验(2组):
A组(老师演示):碳酸钠与盐酸反应;
B组(学生完成):碳酸氢钠与盐酸反应。用下图装置进行实验(即课本实验11-1),观察现象,填写下表:
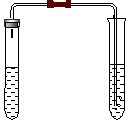
| 实验现象 | 化学方程式 | 由此可得出的结论(规律) | |
碳酸钙+盐酸 | 有气泡产生 | CaCO3+2HCl=CaCl2+CO2↑+H2O | 填写: |
碳酸钠+盐酸 | 填写: | 填写: | 填写: |
碳酸氢钠+盐酸 | 填写: | 填写: | 填写: |
(小结) 碳酸根离子的检验:取样品于试管中,加入适量的稀盐酸,若有气体生成,把生成的气体通入澄清的石灰水,若石灰水变浑浊,则证明此为碳酸盐。
(家庭小实验) 厨房里的两只调料瓶中都放有白色固体,只知道它们分别是精盐(NaCl)、纯碱(Na2CO3)中的某一种。请你利用家中现有的条件将它们区分开来。简要叙述实验步骤、现象、结论。
2、与碱反应
(展示皮蛋图片引出下面的实验)(课本实验11-2)
现象 | |
化学方程式 | |
(分析)下列四个反应的反应物和生成物都是单质还是化合物?反应物是通过什么方式变成了生成物?
CaCO3+2HCl=CaCl2+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+2HCl=NaCl+H2O+CO2↑ Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
(小结)复分解反应的概念。
练习1.下列化学反应属于复分解反应的是( )
A、Zn+H2SO4=ZnSO4+H2↑ B、2KMnO4==K2MnO4+MnO2+O2↑
C、CaO+H2O=Ca(OH)2 D、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
复分解反应的概念
(讨论1)
1.酸和碱作用生成盐和水的反应是否也是复分解反应?为什么?
2.是不是所有的酸、碱、盐之间都能发生复分解反应?
3.分析、归纳上述几个酸、碱、盐之间的复分解反应,它们的生成物有什么特点?
(小结)酸、碱、盐之间发生复分解反应的条件。
(演示动画)为何生成有沉淀或气体或水复分解反应就能发生?
(练习)下列物质间能否发生复分解反应(可利用书后p111附录Ⅰ所提供的信息)?如能发生反应,写出有关反应的化学方程式。
(1)硫酸和硝酸钠溶液
(2)氢氧化钾溶液和硝酸
(3)氯化钠溶液和硝酸银溶液
(4)碳酸钾溶液和盐酸
(资料)我国制碱工业的先驱——侯德榜
(资料)石笋和钟乳石的形成(课后阅读)
(学生反思与小结)这节课你学到了什么?(收获、体会、方法、感想……)
中考 高考名著
常用成语