金属的化学性质 教学设计2
一、 教学设计思路
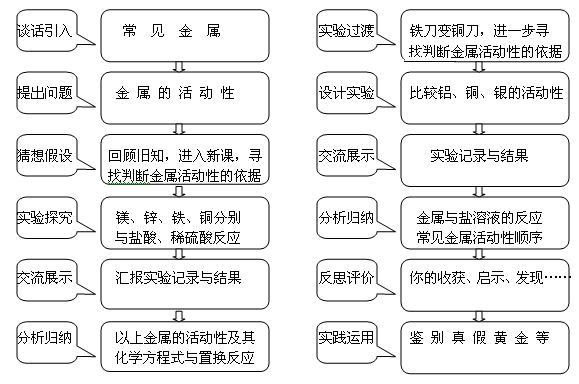
二、 教案
教师活动 | 学生活动 | 设计意图 | |
师生共同探究实验原理:以Mg和盐酸的反应为例,分析、判断产物,书写化学方程式;并强调Fe+HCl生成FeCl2(氯化亚铁)。 问:这种反应跟以前所学的反应类型有什么不同?
以前我们所学的化学反应中,是否也有置换反应呢? 演示实验:铁刀变铜刀
问: 怎样比较铝、铜、银的活动性?(提示:银不与盐酸、稀硫酸反应) 探究二:铝、铜、银的活动性及常见金属的活动性
1、 根据给出的实验仪器、药品设计实验证明Ag、Cu、Al的活动性 | 学生得出生成H2和MgCl2 书写镁和盐酸反应的化学方程式 类推其他反应的化学方程式
对比、分析归纳得出置换反应: A+BC==B+AC
联想到铁钉与硫酸铜溶液的反应
写出化学方程式: Fe+CuSO4==FeSO4+Cu
分组设计实验方案 |
增加新知
通过置换反应过渡既回忆旧知又引出金属与化合物溶液的反应
充分发挥学生的主观能动性
掌握由个别到一般的认识事物的规律 加强记忆 | |
实 验 | 现 象 | 反应的化学方程式 | |
铝丝浸入CuSO4溶液中 |
|
| |
铜丝浸入AgNO3溶液中 |
|
| |
铜丝浸入Al2(SO4)3溶液中 |
|
| |
2、教师巡视并指导实验
3、收集证据 收集学生的实验用试管,展示给同学们看。 拿出课前做好的铜树、银树进行展示。并说明效果为什么好一些。
1、 解释与结论 师生共同归纳出金属活动顺序表 K Ca Na Mg Al Zn Fe Sn 金属活动性由强逐渐减弱 带读 |
进行分组实验,并完成实验报告(或自己设计实验报告)
学生观察、对比
分析、解释得出: Al Cu Ag
金属活动性由强减弱 pb (H) Cu Hg Ag pt Au 自读 | ||
提问:金属活动顺序有那些意义和作用?
反思与评价
实践运用
| 师生共同讨论得出: ① 在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。 ② 在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。 ③在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的化合物的溶液里置换出来。
学生上台:谈体验以及收获、启示、发现…… 1、 设计实验方案:鉴别真假黄金 2、 判断下列反应类型 H2+CuO△Cu+H2O 2Al+6HCl==2AlCl3+3H2↑ 2KMnO4△K2MnO4+MnO2+O2↑ 3Fe+2O2点燃Fe3O4 3、铝在空气中能跟氧气反应,为什么生活中却有那么多的铝制品?如铝制炊具。 |
总结规律,指导应用
运用知识并与生活实际相结合 | |
| |||
中考 高考名著
常用成语
