铁及其化合物的性质 教学设计
【教学目标】
1、 了解铁在自然界中的存在、铁的物理性质及用途。
2、 掌握铁的化学性质、Fe2+及Fe3+的检验及性质、铁的氢氧化物的制备及性质。
3、 了解铁盐的净水原理。
【教学重点】
1、 铁与水蒸气
2、 Fe2+及Fe3+的检验及性质。
3、 铁的氢氧化物的制备及性质。
4、
【突破方法】
立足初中所学相关基础知识,运用物质间相互转化的基本反应规律及氧化还原反应中的基本概念和规律来进行指导学习,并以此设计相关实验进行探究验证学习。
【教学方法】
实验探究教学法。
【教学过程】
阅读并回答问题:
人类用铁的历史
人类使用铁的历史可以追溯到4500多年前,不过那时的铁是从天而降的陨铁(其中含铁90% 以上)。铁是天体演化过程中的一个重要产物。在漫长的岁月中,宇宙中的氢、氦经一代又一代的、聚变,产生了碳氧、氖、镁,镁再聚合成硅,最后形成铁。铁很稳定,是浩渺宇宙中普遍存在的一种重要元素。铁在地球的生物进化过程中也至关重要。距地面3 000 km深处的地心就是铁和镍的熔融体(含铁90%),但目前还无法开采。目前,铁的主要来源是蕴藏在地表层的铁矿石。
铁(Fe)这元素占地壳元素总量的5.5%,世界上的金属总产量中钢铁占99.5%。自然界中自然铁极少,大部份和氧结合成铁矿石。纯铁呈灰白色,强度不是很大,故用处不大。通常我们所说的铁,或钢,其实是一种合金,这种合金主要成份为纯铁(Fe,含有锰,铬,钨等金属元素及碳,硅,硫磷等非金属元素。其中碳所扮演的角色最为重要,它决定铁是否有展延性,是不是很脆,容不容易熔化。
将铁矿石加入高炉还原而得的“熔铣”(hotmetal,即熔融生铁)含碳2到7.5%。将熔铣浇注到模中得一定的形状,称为铸铁(castiron)。铣铁(或生铁)无法锻造、轧制或压制,换句话说,它不允许作任何形式的机械变形。铣铁有白铣(whitepig iron)和灰铣(grey pig iron)的区别。白铣中的碳以碳化铁(Fe3C)的形式存在,故新的断口呈银白色;且因碳化铁硬而脆,所以白铣较硬且脆。至于灰铣中的碳以石墨的形式出现,故断口为灰色,且较白铣软且勒。
磷与硫对铁来说,是很令人讨厌的元素,虽然磷可使铁之流动性变佳,但也使得铁变脆(此因磷与铁结合或硬脆的Fe3p)。至于硫呢?如果铁中含硫过多,则有热脆现象发生,即铁在高温加工的操作下脆裂(这是因为硫与铁结合成为硫化铁,铁与硫化铁成为共晶,形成网状,围绕在铁的晶体周围,因为共晶体的熔点较铁为低,所以在高温加工的温度下,铁与硫的共晶体熔融而铁未熔;此时若加以外力,铁即生裂痕)。
如果加入某些特定的合金元素——锰、铬、镍、钼等等,可以增加钢铁的延性、抗拉强度,硬度,改进其铸造性质,增加其对腐蚀与热的抵抗力。经过热处理(即将钢料加热至某一预定高温,再以各种速率使其冷却),可以改变钢料的机械性质和物理性质。再者,钢铁容易施以机械加工而得到所需要的尺寸和形状。钢铁因为具有这些特性,所以广泛地用来制造各种机械,设备及建筑楼房。一般将含碳量高于2%的铣铁或铸铁称为铁,而将含量少于2%的称为钢。
1、铁在自然界中以存在,这是因为其化学性质。
2、纯铁具有金属光泽,质,有良好的性,铁的密度是7.86g/cm3,熔点1535℃,沸点2750℃。铁还是电和热的导体。鉴别铁和铜最简单的方法是。
3、赤铁矿主要成分,黄铁矿主要成分,菱铁矿主要成分
(写化学式),由赤铁矿炼铁的化学反应方程式为。
4、完成下列表格:
现象 | 化学反应方程式 | |
Fe在氧气中燃烧 | ||
Fe与CuSO4溶液反应 | ||
Fe与盐酸反应 |
设计思想:通过对铁的历史回顾,不仅让学生了解铁的性质,以及铁与人类生活、社会发展紧密联系在一起,更重要的是通过这样的教学设计,尝试探索培养学生阅读能力,自学能力,获取信息的能力的有效途径。
【实验探究】
探究一、铁与水反应条件及产物的研究
1、实验设计及探究
实验目的 | 实验设计 | 现象 | 结论 | |
1 | 反应条件的确定 | |||
2 | 反应产物的确定 | |||
反应方程式 | ||||
2、思考与交流:
(1)点燃上述气体前必须进行的操作是,用文字表达其具体操作
。
(2)如果要收集干燥的气体,应在发生装置与收集装置间接一装置,所用药剂为。
(3)如果想测所产生气体的体积,应如何操作
。
(4)运用双线桥标出上述反应方程式中电子转移方向和数目,并指出氧化剂和还原剂。
(5)当上述反应转移2 mol电子时,在标准状态下,气体的体积为。
探究二、设计实验判断FeO、Fe2O3是哪一类氧化物
1、实验设计及探究
实验目的 | 实验设计 | 现象 | 结论 | |
1 | 水溶性 | |||
2 | 与酸反应 | |||
结论 | ||||
2、学与问:
(1)Fe2O3俗称,其颜色为,利用该性质,Fe2O3可用于制造。
(2)上述操作中,使用胶头滴管滴加药品要注意的事项是。
探究三、检验Fe2+和Fe3+试剂选择的研究
滴加KSCN溶液 | 现象 | |
FeCl3溶液 | ||
FeCl2溶液 |
探究四、Fe3+氧化性的研究
加入 | 现象 | 结论 |
铁粉,KSCN溶液 | ||
加入氯水,振荡 |
思考与交流:
(1)往FeCl2溶液中加入铜片,现象为,反应的离子方程式为______________;往FeCl3溶液中加入铜片,现象为,反应的离子方程式为。
(2)Fe2+、Fe3+、Cu2+的氧化性强弱顺序为。
(3)某溶液中可能含有Fe2+或Fe3+之一,请设计实验予以确认。(要求仪器、药品、现象、结论)
探究五、Fe(OH)2与Fe(OH)3制备条件及化学性质的研究
1、 实验设计与探究
实验目的 | 药品 | 装置或操作 | 现象 | 化学反应方程式 |
Fe(OH)2制备 | ||||
Fe(OH)3制备 |
2、验证Fe(OH)2与Fe(OH)3的化学性质
Fe(OH)2 | Fe(OH)3 | |||
现象 | 化学反应方程式 | 现象 | 化学反应方程式 | |
加H2SO4溶液 | ||||
加热 | ||||
思考与交流:
由于Fe(OH)2易被空气中的O2氧化而很难观察到其白色,如何改进实验以避免这种情况,以便较长时间地观察到实验现象的变化。请提出改进方案。
设计思想:培养学生依据现有基础,尝试设计实验(原理、装置、操作、现象、结论)来学习化学的能力,同时让学生在学习过程中学会表达、讨论、交流共享、分析数据等。
【知识重整】
1、用流程图的形式表示铁及其重要化合物之间的转化关系。
2、Fe2+和Fe3+的鉴别。
Fe2+ | Fe3+ | |
溶液的颜色 | ||
加碱溶液 | ||
加KSCN溶液 |
3、 Fe(OH)2与Fe(OH)3的化学性质。
Fe(OH)2 | Fe(OH)3 | |
物理性质 | ||
化学性质 | ||
制法 |
设计思想:养成学生课后回顾小结知识的习惯,培养知识整理的能力。
【练习】
1.下图中A、B均为带支管试管,先在A中加入足量铁粉,再从漏斗中加入一定量的稀硫酸溶液和少量CuSO4溶液。
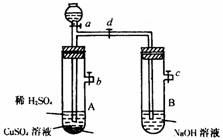
(1)若装入药品后b、d立即同时关闭,打开a,产生的现象为,此装置的原理类似于的工作原理。
(2)若加入药品后马上关闭a、b,打开c、d,A管内的物质充分反应。B管中可观察的现象为。B管中发生反应的方程式为。
(1)A管中有气泡冒出,溶液由淡蓝色逐渐变为浅绿色,且其中的液体被压入漏斗中。启普发生器。(2)A管内液体压入B管中;使B管内液面升高,同时生成白色沉淀,该白色沉淀变成灰绿色,最后变成红褐色。
2、在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉.这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称"引火铁".请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和"引火铁".实验中必须使用普通铁粉和6摩/升盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).
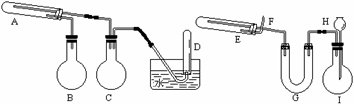 |
填写下列空白:
(1)实验进行时试管A中应加入的试剂是;烧瓶B的作用是;
烧瓶C的作用是;在试管D中收集得到的是.
(2)实验时,U型管G中应加入的试剂是;长颈漏斗H中应加入.
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母).
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是.
(5)试管E中发生反应的化学方程式是.
(6)为了安全,在E管中的反应发生前,在F出口处必须;E管中的反应开始后,在F出口处应.
设计思想:让学生运用知识解决问题,有利于师生查缺补漏。
中考 高考名著
常用成语