生活中两种常见的有机物 (教案)
[教学重点]
1.乙醇、乙酸的组成
2.乙醇的取代反应与氧化反应;乙酸的酸性和酯化反应
3.官能团的概念
[教学难点]
建立乙醇和乙酸分子的立体结构模型,从结构的角度认识乙醇的氧化反应和乙酸的酯化反应。
[知识点讲解]
1.金属钠分别与水和乙醇反应的现象比较
金属钠的变化 | 气体燃烧现象 | 检验产物 | 化学方程式 | |
水 | 钠浮在水面上,熔成闪亮的小球四处游动,发出“咝咝”的响声,钠球逐渐变小,最后完全消失。 | 气体在空气安静中燃烧,发出淡蓝色火焰。 | 向反应后的溶液中滴加酚酞,溶液变红,说明有碱性物质生成。 | 2Na+2H2O=2NaOH+H2↑ |
乙醇 | 钠沉在乙醇底部,不熔化,反应缓慢,逐渐放出气泡。 | 向反应后的溶液中滴加酚酞,溶液变红,说明有碱性物质生成。倒扣在火焰上方的烧杯壁上出现液滴,迅速将烧杯倒转过来并加入澄清石灰水,没有明显现象,说明乙醇与金属钠反应生成的气体是氢气。 | 2CH3CH2OH+2Na 2CH3CH2ONa+H2↑ |
2.乙醇和乙酸的分子结构
乙醇分子中含有一个羟基(—OH),羟基是乙醇的官能团。乙醇的结构式为: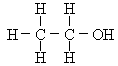 ,通常简写为CH3CH2OH或C2H5OH。
,通常简写为CH3CH2OH或C2H5OH。
乙酸分子中含有一个羧基(—COOH),羧基是乙酸的官能团。乙酸的结构式为:
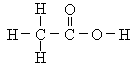 ,通常简写为CH3COOH。
,通常简写为CH3COOH。
3.烃的衍生物和官能团的概念
(1)烃的衍生物
烃分子中的氢原子被其他原子或原子团所取代而生成的化合物称为烃的衍生物。
(2)官能团
烃的衍生物分子中取代氢原子的其他原子或原子团使得该物质具有不同于相应烃的特殊性质,这些原子或原子团被称为官能团。分子中具有相同官能团的物质具有相似的性质。
4.乙醇的重要化学性质
(1)乙醇与金属钠的反应:2CH3CH2OH+2Na2CH3CH2ONa+H2↑
(2)乙醇的氧化反应
①乙醇的燃烧:CH3CH2OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
②乙醇的催化氧化反应:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
乙醛
③乙醇在常温下的氧化反应
CH3CH2OH![]() CH3COOH
CH3COOH
5.乙酸的重要化学性质
(1)乙酸的酸性
①乙酸能使紫色石蕊试液变红
②乙酸能与碳酸盐反应,生成二氧化碳气体
利用乙酸的酸性,可以用乙酸来除去水垢(主要成分是CaCO3):
2CH3COOH+CaCO3(CH3COO)2Ca+H2O+CO2↑
乙酸还可以与碳酸钠反应,也能生成二氧化碳气体:
2CH3COOH+Na2CO32CH3COONa+H2O+CO2↑
上述两个反应都可以证明乙酸的酸性比碳酸的酸性强。
(2)乙酸的酯化反应
①反应原理
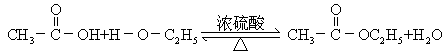
乙酸与乙醇反应的主要产物乙酸乙酯是一种无色、有香味、密度比水的小、不溶于水的油状液体。
②用乙酸和乙醇反应制取乙酸乙酯的实验的注意事项
I 酯化反应是可逆反应,反应速度较慢,要用浓硫酸做催化剂,并加热。
Ⅱ 向试管内加入化学试剂的顺序:乙醇浓硫酸乙酸,注意不能先加浓硫酸,防止液体飞溅。
Ⅲ 导管末端不能插入饱和碳酸钠溶液中,防止液体倒吸到盛反应物的试管中。
Ⅳ 饱和碳酸钠溶液的作用:溶解挥发出来的乙醇;与挥发出来的乙酸反应生成可溶于水的乙酸钠,便于闻到
乙酸乙酯的香味;抑制乙酸乙酯在水中的溶解,使乙酸乙酯与碳酸钠溶液分层,便于得到反应生成的酯。
[典型例题剖析]
例1下列物质中可用来鉴别乙酸、乙醇、苯的是( )
A.金属钠 B.溴水 C.碳酸钠溶液 D.紫色石蕊试液
答案:碳酸钠溶液
解析:碳酸钠能与乙酸,故将碳酸钠溶液加入到乙酸中,有气泡产生;乙醇能与水以任意比混溶,将碳酸钠溶液加入乙醇中,不会出现分层;苯极难溶于水,将碳酸钠溶液加入苯中,出现液体分层现象。
例2A、B、C、D都是含碳、氢、氧的单官能团化合物,A水解得到B和C,B在不同条件下氧化可以得
到C或D,C中氧元素的质量分数比D中的高。若M(X)表示X的摩尔质量,则下式中正确的是( )
A.M(A)=M(B)+M(C) B.2M(D)=M(B)+M(C)
C.M(B)<M(D)<M(C) D.M(D)<M(B)<M(C)
答案:D
解析:A能发生水解,故A是酯,B可以发生氧化,故B是醇,B氧化产生的C和D中,C中氧元素的质量分数比D中的高,故C是羧酸,D是醛。所以表示这四种物质的摩尔质量的相对大小正确的是D选项。
中考 高考名著
常用成语