如何判断离子方程式的正误
要快速准确地判断离子方程式的正误,就必须牢固地掌握书写离子方程式的规则。根据规则写出正确的离子方程式。
一、书写离子方程式的规则
写出配平的分子方程式;将难溶的固态物质,难电离的物质和气态物质写成分子式(或化学式);完全溶解的强电解质写成离子式;消去方程式等号两边未参加反应的离子,即得离子方程式。
1.将难溶的固态物质写成分子式
例如,硝酸银溶液和氯化钠溶液反应的离子方程式的书写过程为:
AgNO3+NaCl=AgCl↓+NaNO3
Ag++NO3-+Na++Cl-=AgCl↓+Na++NO3-
离子方程式为:
Ag++Cl-=AgCl↓
常见物质的溶解性:
(1)盐类
硝酸盐 绝大多数金属和铵的硝酸盐能溶于水。
硫酸盐 Li+,Na+,K+,NH4+,Be2+和Mg2+等的硫酸盐易溶于水,CaSO4微溶于水,SrSO4难溶于水,BaSO4不溶于水和酸。
碳酸盐 Na+,K+和NH4+的碳酸盐易溶于水,Ca2+,Sr2+,Ba2+,Fe2+,Pb2+,Zn2+和Ag+等的碳酸盐难溶于水。
磷酸正盐和酸式磷酸盐 Na3PO4易溶于水,K3PO4可溶于水,Ca3(PO4)2难溶于水,Ca(H2PO4)2等易溶于水;K+,Na+和NH4+等的磷酸一氢盐溶于水。
氯化物 Pb2+,Ag+和Hg22+的氯化物难溶于水;碱金属,碱土金属和铵的氯化物易溶于水。
硫化物 碱金属,碱土金属和铵的硫化物易溶于水;Fe2+,Mn2+,Co2+,Ni2+,Zn2+等的硫化物难溶于水,可溶于稀酸;Cu2+,Cd2+,Bi3+,Hg2+,As3+,Sb3+,Sn2+和Ag+等的硫化物不溶于水和稀酸。
(2)碱类
碱金属的氢氧化物易溶于水,Ca(OH)2微溶于水,Ba(OH)2可溶于水;其他大多数金属的氢氧化物难溶于水,例如,Al(OH)3,Mg(OH)2,Cu(OH)2和Fe(OH)3等。
(3)酸类
H2SO4,HNO3,H3PO4,HCl和HClO4等易溶于水;H2SiO3和H2WO4等难溶于水。
2.将难电离的物质写成分子式
例如,氢氧化钠溶液和稀硫酸溶液完全反应的离子方程式的书写过程为:
2NaOH+H2SO4=Na2SO4+2H2O
2Na++2OH-+2H++SO42-=2Na++SO42-+2H2O
离子方程式为:
OH-+H+=H2O
这就是强碱与强酸中和反应的离子方程式。
又如,次氯酸钠溶液与H2CO3溶液的反应为:
NaClO+H2CO3=NaHCO3+HClO
Na++ClO-+H2CO3=Na++HCO3-+HClO
离子方程式为:
ClO-+H2CO3=HCO3-+HClO
常见的难电离物质 H2O,H2O2,H2S,HClO,HBrO,HIO,H2CO3,CH3COOH,NH3·H2O和Pb(CH3COO)2等。
3.将气态物质写成分子式
例如,碳酸钠溶液与盐酸完全反应,其离子方程式书写过程为:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
2Na++CO32-+2H++2Cl-=2Na++2Cl-+H2O+CO2↑
CO32-+2H+=H2O+CO2↑
硫化亚铁与盐酸反应的离子方程式为:
FeS+2H+=Fe2++H2S↑
常见的气态物质 CO2,SO2,H2S,HF,HCl,NH3,CH4,SiH4和O2等。
二、如何判断离子方程式的正误
1.净电荷相等原则
在正确的离子方程式中,不但方程式等号两边各元素的原子总数相等,而且两边的净电荷数也要相等。所谓净电荷数是指正电荷总数与负电荷总数的代数和。
例如:
(1)将单质铁与三氯化铁溶液反应的离子方程式写成:
Fe+Fe3+=2Fe2+
在等号左边净电荷数为3+,等号右边净电荷数为4+。显而易见,这个离子方程式两边净电荷数不相等,是错误的。正确的离子方程式是:
Fe+2Fe3+=3Fe2+
该离子方程式两边的净电荷数均为6+。
(2)在加热下,氯气与氢氧化钠溶液反应的正确离子方程式是:
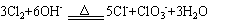
因为该离子方程式的各元素的原子数和净电荷数在方程式两边均相等。
(3)在硫酸介质中重铬酸钾溶液与硫酸亚铁溶液反应的正确离子方程式为:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
在该离子方程式等号两边各元素的原子数相等;在等号左边的净电荷数(2×6+1×14-2=24)是24+,等号右边的净电荷数(3×6+3×2=24)是24+。
2.物料平衡原则
当某电解质的正、负离子完全参加了反应,在配平的离子方程式中,反应物中该正、负离子的个数比,应与其电解质的组成比相同。当某电解质的正、负离子都参加反应,却未完全反应,则在配平的离子方程式中,该正、负离子的个数比与其电解质的组成不相同。例如:
(1)2mol的NaHCO3溶液与1mol的Ca(OH)2溶液反应的离子方程式为:
2HCO-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
显然,反应物中Ca2+的个数与OH-的个数比为1∶2,等于Ca(OH)2的组成比。因此,该离子方程式是正确的。
(2)1mol的NaHCO3溶液与1mol的
Ca(OH)2溶液反应,其离子方程式为:
HCO3-+Ca2++OH-=CaCO3↓+H2O
该离子方程式的反应物中,Ca2+的个数与OH-个数比为1∶1,不是1∶2,仍然是正确的。从分子方程式可看出,OH-未完全反应:
NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH
(3)3mol的磷酸二氢钙溶液与12mol的氢氧化钠溶液完全反应,其离子方程式为:
3Ca2++6H2PO4-+12OH-=Ca3(PO4)2+4PO43-+12H2O
显然,方程式中Ca2+个数与H2PO4-个数比为1∶2,等于
Ca(H2PO4)2的组成比。
如果将这个反应的离子方程式写成:
3Ca2++2H2PO4-+4OH-=Ca3(PO4)2+4H2O
尽管在这个离子方程式中,各元素的原子数是配平的,净电荷数在方程式两边均为零,这个离子方程式仍然是错误的。因为其中Ca2+的个数与
H2PO4-的个数比是3∶2,而不是1∶2。
(4)2mol的NaH2PO4溶液与3mol的
Ca(OH)2溶液反应的离子方程式为:
2H2PO4-+3Ca2++4OH-=Ca3(PO4)2↓+4H2O
虽然该离子方程式中,Ca2+的个数与OH-的个数比为3∶4,而不是1∶2,它仍然是正确的。因为由分子方程式可明显看出,OH-未完全参加反应:
2NaH2PO4+3Ca(OH)2=Ca3(PO4)2↓+4H2O+2NaOH
3.符合事实
配平的离子方程式要与题给条件和实验事实相符合。例如,
(1)等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液完全反应。其正确的离子方程式为:
HCO3-+Ba2++OH-=BaCO3↓+H2O
如果写成:
2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O
尽管在方程式等号两边各元素的原子数是相等的,净电荷数在其两边均为2-,但题给条件Ba2+个数与HCO3-个数之比为1∶1,该方程式中为1∶2。这个离子方程式不符合题给条件,因此,是错误的。
(2)在硫酸介质中,KMnO4溶液与H2O2溶液反应。将其离子方程式写成:
2MnO4-+H2O2+6H+=2Mn2++3O2↑+4H2O
虽然,这个离子方程式的反应物和产物是正确的,在方程式两边各元素的原子数和净电荷数是配平的,却是一个错误的离子方程式。因为实验证实,O2应该完全由H2O2被氧化而产生;MnO4-中的氧原子完全转变成H2O中的氧。由此可见,正确的离子方程式为:
2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
因为正确的分子方程式为:
2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
中考 高考名著
常用成语