几种重要的金属化合物 教学设计2
教学目标:
1、通过学生的实验探究,掌握Na2CO3和NaHCO3的基本性质
2、通过学生的实验探究,掌握Fe2+的还原性和Fe3+的氧化性以及它们的检验方法
3、通过学生的讨论,掌握Na2CO3与NaHCO3以及Fe2+与Fe3+的相互转化关系
4、进一步巩固离子反应方程式的书写和对氧化还原反应理论的理解
教学重点:1、Na2CO3与NaHCO3的相互转化关系
2、Fe2+的还原性和Fe3+的氧化性以及它们的检验方法
教学难点:Na2CO3与NaHCO3以及Fe2+与Fe3+的相互转化关系
教学方法:学生实验探究法,学习小组讨论、交流
教学过程:
[课的引入]:简单介绍盐的分类,例如:Na2SO4和NaHSO4
Na2CO3和NaHCO3
Cu2(OH)2CO3
硫酸盐、碳酸盐、正盐、酸式盐、碱式盐的概念和特点
1、碳酸钠和碳酸氢钠(Na2CO3和NaHCO3)
[学生实验探究1]:书本50页的内容(1)和(2),教师趁堂,同时指导学生实验和记录实验现象,填写书本50页的表一和表二。
[学习小组讨论]:1、观察Na2CO3和NaHCO3的外观。
2、Na2CO3和NaHCO3在水中的溶解度哪个大?
3、Na2CO3和NaHCO3溶于水时吸、放热的情况如何?
4、它们的水溶液的碱性那个强?
5、按书本50页的图3—18装配实验,对Na2CO3和NaHCO3分别进行加热,有什么结果?写出相关的化学反应方程式。
[学生发言]:学习小组派代表发言……
[教师评价和小结]:
1、Na2CO3是白色粉末;NaHCO3是白色细小晶体;
另:Na2CO3的结晶水合物——碳酸钠晶体,及其风化。
2、Na2CO3和NaHCO3都易溶于水,Na2CO3的溶解度大些。
3、Na2CO3和NaHCO3在溶于水时都放热,Na2CO3的放热更多些。
4、它们的水溶液的碱性Na2CO3的更强一些(教师可简单解释原因:CO32-和HCO3-水解的结果)
5、加热Na2CO3时,实验过程无明显现象;加热NaHCO3时,澄清石灰水出现浑浊,说明产生了CO2气体。
2NaHCO3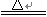 Na2CO3+ H2O + CO2↑
Na2CO3+ H2O + CO2↑
**学习小组长评价各组员的学习过程、相互合作的态度、创造能力。
[学生实验探究2]:书本50页的内容(3),教师趁堂,同时指导学生实验和记录实验现象。
[学习小组讨论]:
1、分别取同样量的Na2CO3和NaHCO3溶液(2-3 mL)于两支小试管中,分别加入足量的盐酸,观察哪支试管的反应剧烈些?
2、取2-3 mL的Na2CO3溶液于小试管中,用胶头滴管逐滴滴加盐酸,仔细观察反应过程和现象。
3、分别取同样量的Na2CO3和NaHCO3溶液(2-3 mL)于两支小试管中,分别滴加澄清石灰水,观察反应现象。
4、写出以上实验的反应离子方程式。
5、Na2CO3与NaHCO3的相互转化关系;正盐与酸式盐的转化关系是怎样的?
[学生发言]:学习小组派代表发言……,并在黑板上板书相关的离子反应方程式。
[教师评价和小结]:
1、在相同情况下,NaHCO3溶液与盐酸反应要比Na2CO3溶液的剧烈。
CO32-+ 2H+== H2O + CO2↑; HCO3-+ H+== H2O + CO2↑。
2、向Na2CO3溶液中逐滴滴加盐酸时,前几滴盐酸的加入并无明显的现象,后几滴盐酸的加入才明显地观察到有气体生成,说明Na2CO3溶液与盐酸的反应是分步进行的。
第一步:CO32-+ H+== HCO + H2O
第二步:HCO3-+ H+== H2O + CO2↑
3、向Na2CO3溶液中逐滴滴加澄清石灰水的反应是:
CO32-+ Ca2+== CaCO3↓
向NaHCO3溶液中逐滴滴加澄清石灰水的反应是:
HCO3- + OH-== CO32-+ H2O; 生成的CO32-再与Ca2+反应:
CO32-+ Ca2+== CaCO3↓
合写为: 2HCO3-+ Ca2++ 2OH-== CaCO3↓+ CO32-+ 2H2O
4、Na2CO3与NaHCO3的相互转化关系:
Na2CO3![]() NaHCO3
NaHCO3
正盐与酸式盐的转化关系:正盐![]() 酸式盐
酸式盐
**学习小组长评价各组员的学习过程、相互合作的态度、创造能力、离子反应方程式书写的情况。
学生阅读书本51页的“资料卡片”,要求学生课外继续查找有关明矾作净水剂的原理。
2、三价铁的氧化性
(1)、Fe3+的检验
[学生实验探究3]:按书本51页的内容(1)进行实验,观察实验现象并记录。
[教师评价和小结]:在Fe2+的溶液中滴加KSCN溶液无明显现象
在Fe3+的溶液中滴加KSCN溶液,溶液变成血红色
Fe3+的检验: Fe3++ 3SCN-=== Fe(SCN)3(血红色)
[学生实验探究4]:按书本51页的内容(2)进行实验,观察实验现象并记录。
[学习小组讨论]:1、通过对Fe2+与Fe3+的比较,找出鉴别和检验它们的方法。
2、写出上述反应的离子方程式。
3、小结Fe2+与Fe3+的相互转化的规律。
[教师评价和小结]:
1、Fe3+的检验方法:观察溶液的颜色;加OH-;加SCN-等
Fe3++ 3SCN-=== Fe(SCN)3(血红色)
Fe2+的检验方法:观察溶液的颜色;加OH-;加SCN-后再加氯水等
2、Fe2+与Fe3+的相互转化: 2Fe3++ Fe == 3Fe2+
2Fe2++ Cl2== 2Fe3++ 2Cl-
Fe3+----- Fe2+:强还原剂:I-、H2S、SO2、金属单质(如Fe、Cu)等
[堂上练习]:见ppt文件
**学习小组长评价各组员的学习过程、相互合作的态度、创造能力、离子反应方程式书写的情况。
[课后作业]:书本54页的习题4、5、7
[教师评价和小结]:1、强调本节课的重点和难点。
2、解决各学习小组长汇报和反映的学习问题。
中考 高考名著
常用成语